Make-Up of the City is een interdisciplinair onderzoeksproject gefinancierd door de Onderzoeksraad van de VUB. Centraal in het project staan meerdere honderden menselijke skeletten uit een 13e en 14e-eeuws parochiekerkhof die in 2018 werden opgegraven in het West-Vlaamse Ieper. Tijdens die 13e en 14e eeuw was Ieper een toonaangevend centrum in de lakenindustrie en één van de grootste steden van Europa. Onderzoekers weten echter niet zoveel over de stad, deels omdat een groot deel van het Ieperse stadsarchief in vlammen opging tijdens de Eerste Wereldoorlog. Aan de hand van de 13e en 14e-eeuwse skeletten wil een team van historici, archeologen, chemie- en anatomiespecialisten die leemtes opvullen en fundamentele vragen over de samenstelling, de herkomst en de gezondheid van de toenmalige Ieperse bevolking beantwoorden. In de praktijk wordt een groot deel van het onderzoek uitgevoerd door doctoraatstudenten Veronica Jackson en Rachèl Spros. Terwijl osteo-archeoloog Veronica zich concentreert op de eigenschappen van de skeletten die zichtbaar zijn met het blote oog, kijkt isotopenexperte Rachèl naar de botten en tanden van de individuen uit Ieper op elementair niveau. Wat dat laatste precies inhoudt, vertelt Rachèl zelf in deze bijdrage.
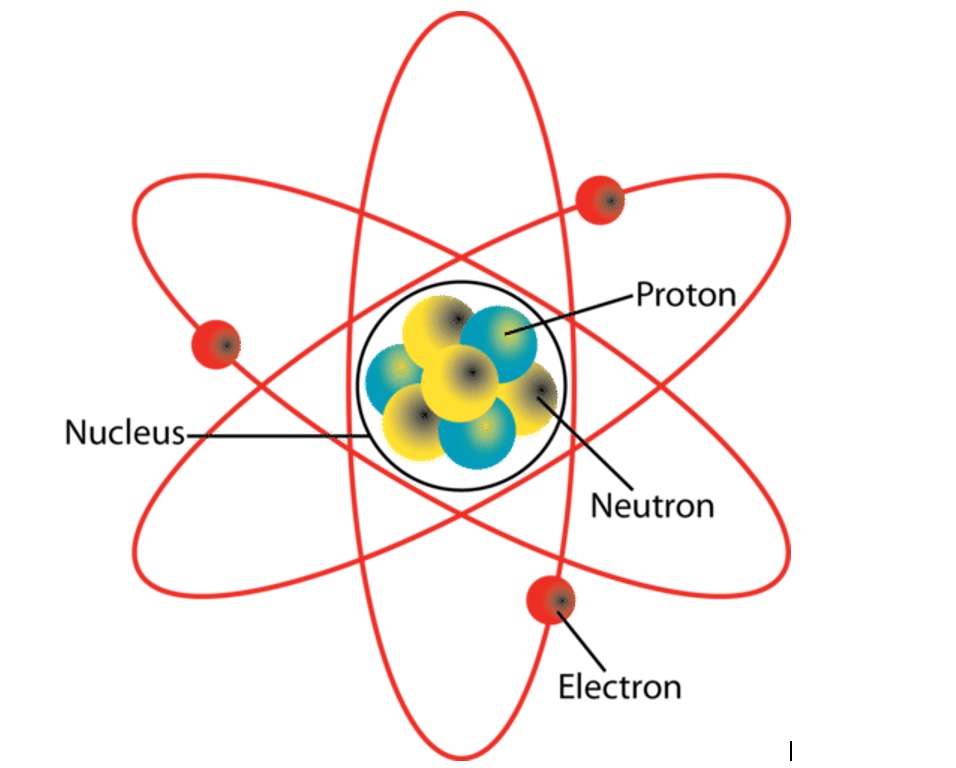 Fig 1: Atoom van lithium (Image source: CK-12 Foundation, Credit: Jodi So)
Fig 1: Atoom van lithium (Image source: CK-12 Foundation, Credit: Jodi So)
Alles om ons heen, van het water in de oceaan, tot de lucht die we ademen, is gemaakt van chemische elementen. Onze lichamen zijn daarop geen uitzondering en bevatten veel elementen zoals onder meer koolstof, stikstof en zuurstof. Deze elementen zijn de bouwstenen voor onze botten, onze tanden en elke cel in ons lichaam. Bekijken we het op een nog kleinere schaal, dan zien we dat deze kleine elementen zelf zijn opgebouwd uit een soort “wolk” van elektronen met in het midden een kern of “nucleus” die op zijn beurt bestaat uit protonen en neutronen. Samen vormen die elektronen, protonen en neutronen een atoom (Fig. 1). In zo’n atoom is het het aantal protonen dat bepaalt welk element het atoom is. Bijvoorbeeld, een ‘’wolk’’ met maar één proton in de nucleus is het element waterstof, een ‘’wolk’’ met zes protonen is het element koolstof.
Het aantal neutronen bepaalt dan weer om welke ‘’versie’’ van het element het gaat. Zo’n versie van één en hetzelfde element wordt een “isotoop” genoemd. Het element koolstof bijvoorbeeld kan 6, 7, of 8 neutronen hebben in de nucleus, met telkens verschillende massa. We spreken daarom over drie verschillende isotopen: het ‘’lichtere’’ isotoop ‘koolstof 12’ (12C), met 12 protonen en neutronen in de nucleus; het iets ‘’zwaardere’’ ‘koolstof 13’ (13C), met 13 protonen en neutronen in de nucleus, en het ‘’zwaarste’’ isotoop ‘koolstof 14’ (14C), met 14 protonen en neutronen samen in de nucleus. Koolstofatomen met 6 neutronen (12C) komen het meest voor in ons lichaam, maar soms vinden we een koolstofatoom met 7 neutronen (13C). Hetzelfde geldt voor de stikstofatomen in ons lichaam en ook voor de meeste andere elementen.
Of ons lichaam meer of minder ‘’zwaardere’’ dan wel ‘’lichtere’’ isotopen van eenzelfde element bevat hangt af van wat we eten en drinken en waar dat eten en drinken vandaan komt. Tijdens de spijsvertering nemen onze lichamen voedingstoffen op en daarmee ook de chemische elementen en de isotopen waaruit die voedingsstoffen zijn opgemaakt. De isotopenverhouding in ons voedsel hangt af van veel verschillende mogelijke invloeden: de positie in de voedselketen, temperatuur, luchtvochtigheid, type grond, fotosynthese, en nog vele andere dingen. Dus de isotopen in ons lichaam zullen altijd ons dieet en het milieu waar ons voedsel vandaan komt weerspiegelen: Je bent wat je eet en waar je eet!
Wat ik doe is het aantal isotopen van verschillende elementen in de botten en tanden van de laatmiddeleeuwse populatie uit Ieper waarrond we in ons project werken analyseren. Op die manier krijg ik inzicht in hun dieet en kom ik te weten waar hun voedsel en drank vandaan kwam. Voor ik de precieze isotopensamenstelling kan achterhalen moet het materiaal echter vele stappen doorlopen: ik moet eerst alle atomen die ik niet wil tellen chemisch verwijderen tot enkel de isotopen van het element waar ik wel in geïnteresseerd ben achterblijven. Dus laten we beginnen bij het begin: het nemen van stalen van een skelet.
Onze lichamen bevatten ongeveer 7 octiljoen atomen (dat zijn 27 nullen!). Gelukkig hoef ik niet zo veel atomen te tellen om een idee te krijgen van de isotopencompositie van een individu. In de plaats daarvan zaag ik kleine secties uit een dijbeen, een rib en twee tanden van een menselijk skelet. Dat laat me toe om de volledige levensgeschiedenis van een individu te achterhalen, van de geboorte tot aan het overlijden. Onze lichamen hebben namelijk tijd nodig om tanden en botten aan te maken en het ene lichaamsdeel zal zich langer blijven ontwikkelen dan het andere. De isotopen die we in een lichaamsdeel vinden, werden gevormd tijdens die specifieke ontwikkelingsperiode. Onze tanden, bijvoorbeeld, tonen enkel de isotopen uit onze kindertijd, terwijl onze botten ons ook de isotopen uit ons volwassen leven laten zien.
De grootte van het bot- en tandfragment dat nodig is voor de analyse wordt bepaald door de bewaringstoestand van het skelet: na verloop van tijd zullen skeletten namelijk afbreken en veel van die 7 octiljoen atomen zullen verdwijnen. Gelukkig voor mij zijn de skeletten uit 13e- en 14e-eeuws Ieper zeer goed bewaard gebleven. Bij sommige individuen was zelfs het kraakbeen nog zichtbaar en was de sponsachtige binnenkant van het bot intact! Daardoor zijn maar een paar gram bot en een paar milligram tandglazuur nodig per individu (Fig. 2). Jammer genoeg betekent een goede preservatie ook dat het uitzagen van stalen heel traag moet gebeuren: doordat het bot nog zo sterk is geeft het meer weerstand en kan de zaag er minder makkelijk doorheen. De zaag geeft daardoor meer wrijving en dus ook meer hitte. De atomen in ons lichaam houden er niet van als er te veel hitte is en veranderen van samenstelling of verdwijnen als ze te lang worden blootgesteld aan hoge temperaturen. Dit probleem zorgt ervoor dat ik maar van ongeveer vijf individuen stalen kan nemen per dag en ik meerdere weken nodig heb om alle individuen te bemonsteren. Pas daarna kan ik beginnen aan de volgende stap in het isotopenonderzoek, de chemische behandeling. Daar zal ik jullie de volgende keer alles over vertellen.
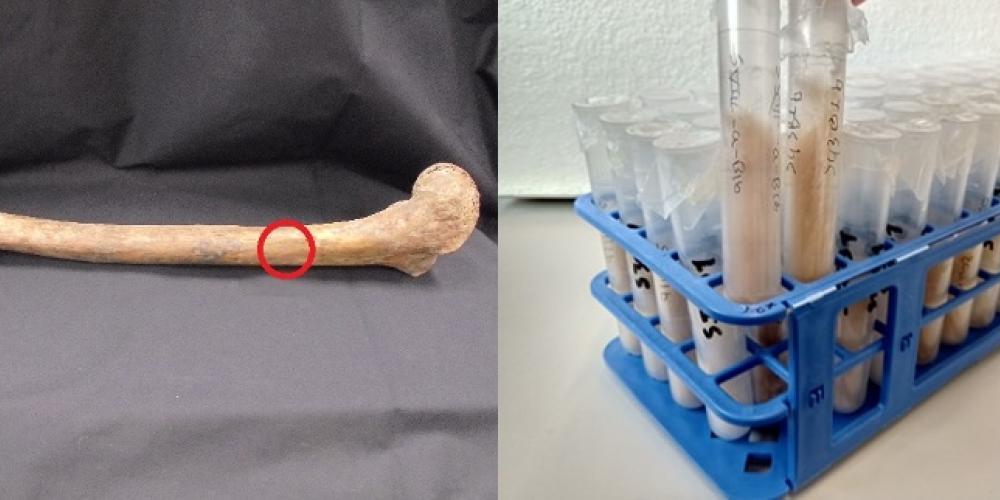
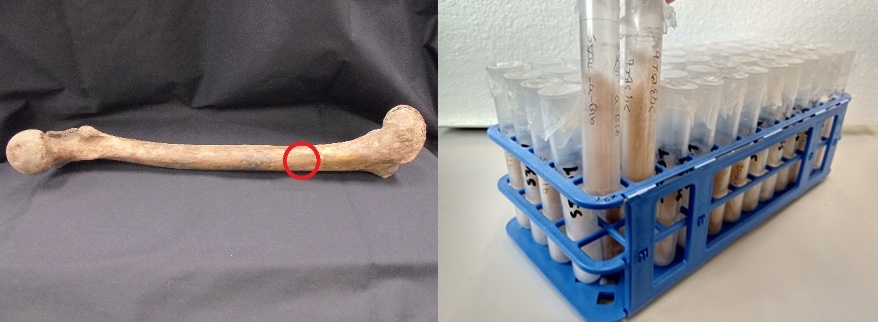 Fig 2: Van bot tot collageen: op de foto links is het bemonsterde deel aangegeven met een rode cirkel, op de foto rechts zie je het collageen eindproduct na de chemische behandeling.
Fig 2: Van bot tot collageen: op de foto links is het bemonsterde deel aangegeven met een rode cirkel, op de foto rechts zie je het collageen eindproduct na de chemische behandeling.